Детская эпилепсия с пароксизмальной активностью на ээг в затылочной области
Содержание:
- Общие сведения о фокальной эпилепсии
- Характеристика эпилептиформной активности
- Аффективно-респираторный синдром: МКБ, классификация
- 3.1. Доброкачественная эпилепсия детского возраста с центрально-височными спайками (роландическая эпилепсия)
- Причины ВСД
- Синдром Леннокса-Гасто.
- Несколько слов об «эпи»-признаках и заключении ЭЭГ.
- Результаты исследований
- Общие принципы лечения эпилепсии
Общие сведения о фокальной эпилепсии
Определение «фокальная эпилепсия» соединяет все формы эпилептических пароксизмов, которые возникают из-за наличия локального очага повышенной эпи-активности в церебральных структурах. Эпилептическая активность начинается фокально, но может распространяться от очага возбуждения на окружающие ткани головного мозга, что обуславливает вторичную генерализацию эпиприступа
Важно дифференцировать пароксизмы ФЭ и приступы генерализованной эпилепсии с первично-диффузным характером возбуждения. Помимо этого, существует мультифокальная форма эпилепсии
При этой форме эпилепсии имеются несколько локальных эпилептогенных зон в головном мозге.
Примерно 82% от всех эпилептических синдромов составляет фокальная эпилепсия, причём в 75% случаев она начинается в детском периоде. Чаще всего она возникает на фоне травматического, ишемического или инфекционного поражения, нарушений развития головного мозга. Вторичная фокальная эпилепсия подобного характера диагностируется у 71% всех пациентов, страдающих эпилепсией.
Характеристика эпилептиформной активности
Для количественной и объективной оценки ЭЭГ каждый графоэлемент может быть описан рядом параметров: типом, амплитудным максимумом, симметричностью, продолжительностью и др.
➥Более подробно: Визуальные характеристики ЭЭГ
Типы разрядов
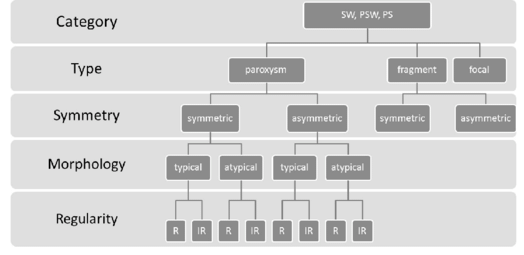 Иерархическая классификация эпилептиформных разрядов
Иерархическая классификация эпилептиформных разрядов
SW = комплекс спайк-волна, PSW = комплекс полиспайк-волна, PS = полиспайк, R = регулярные, IR = нерегулярные
Эпилептиформная активность классифицируется по длительности на:
- фрагменты (длительность <2 с)
- пароксизмы (длительность ≥2 с)
Бифронтальные разряды (как симметричные, так и асимметричные) относятся к фрагментам фронтальной экспрессии генерализованной эпилептиформной активности и не классифицируются как очаговые.
Амплитудный максимум
Амплитуда волны измеряется от пика до пика и выражается в микровольтах. Когда максимальная амплитуда осциллограммы зашкаливает в отведениях F3, F4 и Fz, она маркируется как фронто-центральный максимум. Аналогично, Fp1, F3, Fp2, F4 и O1, O2 определяются как фронто-полярные и затылочные максимумы соответственно.
Амплитудная симметрия
Канал ЭЭГ, показывающий максимальную амплитуду эпилептиформных разрядов, берется за эталон и сравнивается с тем же каналом в противоположном полушарии. Более 50% разницы амплитуд между полушариями принимается за амплитудную асимметрию.
Регулярность пароксизмов
Генерализованные пароксизмы определяются как нерегулярные, когда вместо регулярных ритмических иктальных разрядов имеются медленные волны или комплексы различной частоты и/или морфологии, или короткие (<1 с), кратковременные прерывания судорожных приступов.
Морфология
Классический отрицательный пик/-ки, сопровождаемый куполообразной волной, основанный на визуальном анализе, рассматривался как типичная морфология. Волны без спайков и спайков поверх волны считаются нетипичными. Когда ≥50% разрядов пароксизма имеют аномальную морфологию, он классифицировался как пароксизм аномальной морфологии.
Фотопароксизмальный ответ
Генерализованные спайко-волновые, полиспайк-волновые и/или полиспайковые разряды, вызванные прерывистой фотостимуляцией, определяются как фотопароксизмальный ответ (PPR). Когда PPR сохраняется после окончания стимуляции дольше чем 100 мс, его классифицируют как незатухающий. PPR мoжет отражать идиопатические, генетически детерминированные признаки, которые появляются на ЭЭГ при отсутствии эпилептических приступов.
Чувствительность к закрытию глаз
Чувствительность к закрытию глаз определяли как эпилептиформные разряды, появляющиеся в течение 1–3 с после закрытия глаз и продолжающиеся 1–4 с, но не в течение всего периода с закрытыми глазами.
Аффективно-респираторный синдром: МКБ, классификация
- Легкая стадия. Длится около 15 секунд, ребёнок не способен нормально дышать. Опасности для мозга нет, но всё равно стоит обратиться к неврологу.
- «Бледная» стадия. Возникает из-за внешних факторов. Например, из-за боли, удара, укола или падения. При приступах, у ребёнка наблюдается бледность, он может упасть в обморок. Аффективные симптомы типа плача или крика могут не проявляться.
- «Синяя» стадия. Катализатором приступов является окружающая обстановка: стресс, давление, сильное возбуждение. Симптомами при этой стадии являются: кожа становится синей, апноэ длится около 20 секунд, в редких случаях проявляются судороги.
- Осложнённый Аффективно-респираторный синдром. Часто проявляется у грудничков. Данная стадия отличается от прошлых своей сложностью и длительностью приступов. Синдром проявляется не только из-за темперамента или характерных особенностей, но и из-за проблем с ЦНС.
3.1. Доброкачественная эпилепсия детского возраста с центрально-височными спайками (роландическая эпилепсия)
Общая характеристика
Роландическая эпилепсия — одна из форм идиопатической локально обусловленной эпилепсии детского возраста, проявляющаяся преимущественно ночными короткими гемифациальными моторными приступами и имеющая благоприятный прогноз.
Роландическая эпилепсия проявляется в возрасте 2–14 лет. Приступы могут быть парциальными и вторично-генерализованными. Большинство парциальных приступов являются моторными. Типичные приступы, возникающие как в состоянии бодрствования, но все чаще во время сна (преимущественно первая половина ночи), протекают обычно при сохранном сознании и начинаются с соматосенсорной ауры, характеризующейся парестезией щеки, мышц глотки и гортани, ощущением булавочных уколов, онемения в щеке, деснах, языке на стороне, противоположной фокусу. Затем появляются моторные феномены в виде односторонних гемифациальных (с вовлечением лицевой мускулатуры) клонических или тонико-клонических судорог, которые могут распространяться на гомолатеральную руку (фацио-брахиальные приступы) и ногу (унилатеральные приступы).
В начале приступа или в процессе его развития возникают затруднения речи, выражающиеся в полной невозможности говорить или произносить отдельные звуки. Наряду с анартрией отмечается гиперсаливация, характеризющаяся обильной продукцией и выделением изо рта слюны, что способствует возникновению хлюпающих, хрюкающих звуков.
Длительность приступов, как правило, не более 2–3 мин, частота в среднем — 2–6 раз в год .
При роландической эпилепсии в единичных случаях возможно развитие эпилептического статуса .
Для больных с роландической эпилепсии характерен нормальный интеллект и неврологический статус, хотя ряд современных исследователей все же указывают на наличие у таких детей нейропсихологической недостаточности .
Ряд авторов отмечают возможность возникновения при роландической эпилепсии приступов, характеризующихся болями в животе, головокружением, зрительными феноменами (вспышки света, слепота, мелькание предметов перед глазами), которые обычно отмечаются у детей моложе 5 лет; сложных парциальных приступов или типичных абсансов .
К атипичной роландической эпилепсии (синдром псевдоленнокса) относят группу больных в возрасте 2–8 лет, у которых отмечаются простые парциальные гемифациальные и гемиклонические ночные приступы, сочетающиеся с миоклонически-астатическими, атоническими пароксизмами и в ряде случаев с абсансами , но никогда в отличие от истинного синдрома Леннокса-Гасто не бывает тонических судорог . Частота приступов обычно высокая. До дебютирования приступов у детей не отмечается нарушений в нервно-психическом развитии.
Электроэнцефалографические паттерны
Приступная и межприступная ЭЭГ у больных с роландической эпилепсией характеризуется нормальной основной активностью и обычно дифазными спайками, за которыми следует медленная волна. Спайки или острые волны появляются одиночно или группами в средне-височной и центральной области или височно-центрально-теменной области . Они могут наблюдаться как унилатерально (обычно контралатерально гемифациальным приступам), так и билатерально (синхронно или асинхронно). «Роландические» комплексы обычно наиболее отчетливо выражены при открытых глазах (рис. 3.1).
В ряде случаев на ЭЭГ регистрируются генерализованные комплексы «спайк-волна», типичные для абсансов. Острые волны также могут располагаться в затылочной области . Также во время ночного приступа на ЭЭГ может регистрироваться низкоамплитудная быстрая активность в центрально-височной области, переходящая в роландические комплексы с распространением на всю гемисферу и с последующей генерализацией .
При атипичной роландической эпилепсии (синдром псевдоленнокса) фоновая ЭЭГ не изменена либо слегка замедлена и дизорганизована (рис. 3.2а), в ряде случаев, преимущественно в лобных отделах. Типичные роландические спайки могут сочетаться с медленными комплексами «острая-медленная волна», характерными для синдрома Леннокса-Гасто, или нерегулярной диффузной пик-волновой активностью частотой около 2,5 кол./с и амплитудным региональным преобладанием в лобных отделах; могут определяться фокальные спайки или медленные волны в центрально-височной области или центрально-височно-теменной области (рис. 3.2б).
В приступной ЭЭГ может отмечаться асинхронное появление разрядов высокоамплитудных нерегулярных диффузных комплексов «пик-волна» или «острая-медленная волна» частотой 1.5–4 кол./с длительностью 3–10 с, синхронно с пароксизмом атипичных абсансов .
Причины ВСД
В основе заболевания — нарушение нейрогуморальной регуляции вегетативной нервной системы, отвечающей за стабильность и слаженность деятельности всех внутренних органов и организма в целом. Это отдел нервной системы, не подчиняющийся сознанию и управлению волей человека.
Причин заболевания много. Среди первых выступают гормональные нарушения, в том числе преходящие — в период полового созревания, менопаузы, беременности. Существенную роль играют инфекционные болезни (в том числе и физическая детренированность после инфекции), очаги хронической инфекции (кариес, синусит, тонзиллит), аллергия. Предрасполагают к расстройству психоэмоциональное перенапряжение ,черепно-мозговые травмы, малоподвижный образ жизни, вредные привычки — курение, алкоголь, неправильное питание
Важное значение имеет наследственная предрасположенность
Синдром Леннокса-Гасто.
Синдром Леннокса-Гасто (СЛГ) – эпилептическая энцефалопатия детского возраста, характеризующаяся полиморфизмом приступов, специфическими изменениями ЭЭГ и резистентностью к терапии. Частота СЛГ составляет 3-5% среди всех эпилептических синдромов у детей и подростков; болеют чаще мальчики.
Заболевание дебютирует, преимущественно, в возрасте 2-8 лет (чаще 4-6 лет). Если СЛГ развивается при трансформации из синдрома Веста, то возможно 2 варианта:
Инфантильные спазмы трансформируются в тонические приступы при отсутствии латентного периода и плавно переходят в СЛГ.
Инфантильные спазмы исчезают; психомоторное развитие ребенка несколько улучшается; картина ЭЭГ постепенно нормализуется. Затем спустя некоторый латентный промежуток времени, который варьирует у разных больных, появляются приступы внезапных падений, атипичные абсансы и нарастает диффузная медленная пик-волновая активность на ЭЭГ.
Для СЛГ характерна триада приступов: пароксизмы падений (атонически- и миоклонически-астатические); тонические приступы и атипичные абсансы. Наиболее типичны приступы внезапных падений, обусловленные тоническими, миоклоническими или атоническими (негативный миоклонус) пароксизмами. Сознание может быть сохранено или выключается кратковременно. После падения не наблюдается судорог, и ребенок сразу же встает. Частые приступы падений приводят к тяжелой травматизации и инвалидизации больных.
Тонические приступы бывают аксиальными, проксимальными или тотальными; симметричными либо четко латерализованными. Приступы включают в себя внезапное сгибание шеи и туловища, подъем рук в состоянии полуфлексии или разгибания, разгибание ног, сокращение лицевой мускулатуры, вращательные движения глазных яблок, апноэ, гиперемию лица. Они могут возникать, как в дневное время, так и особенно часто, ночью.
Атипичные абсансы также характерны для СЛГ. Проявления их многообразны. Нарушение сознания бывает неполным. Может сохраняться некоторая степень двигательной и речевой активности. Наблюдается гипомимия, слюнотечение; миоклонии век, рта; атонические феномены (голова падает на грудь, рот приоткрыт). Атипичные абсансы обычно сопровождаются понижением мышечного тонуса, что вызывает как бы “обмякание” тела, начиная с мышц лица и шеи.
В неврологическом статусе отмечаются проявления пирамидной недостаточности, координаторные нарушения. Характерно снижение интеллекта, не достигающее, однако, тяжелой степени. Интеллектуальный дефицит констатируется с раннего возраста, предшествуя заболеванию (симптоматические формы) или развивается сразу после появления приступов (криптогенные формы).
При ЭЭГ-исследовании в большом проценте случаев выявляется нерегулярная диффузная, часто с амплитудной асимметрией, медленная пик-волновая активность с частотой 1,5-2,5 Гц в период бодрствования и быстрые ритмические разряды с частотой около 10 Гц – во время сна.
При нейровизуализации могут иметь место различные структурные нарушения в коре головного мозга, включая пороки развития: гипоплазия мозолистого тела, гемимегалэнцефалия, кортикальные дисплазии и пр.
В лечении СЛГ следует избегать препаратов, подавляющих когнитивные функции (барбитураты). Наиболее часто при СЛГ применяются вальпроаты, карбамазепин, бензодиазепины и ламиктал. Лечение начинается с производных вальпроевой кислоты, постепенно увеличивая их до максимально переносимой дозы (70-100 мг/кг/сут и выше). Карбамазепин эффективен при тонических приступах – 15-30 мг/кг/сут, но может учащать абсансы и миоклонические пароксизмы. Ряд больных реагирует на увеличение дозы карбамазепина парадоксальным учащением приступов. Бензодиазепины оказывают эффект при всех типах приступов, однако этот эффект временный. В группе бензодиазепинов применяются клоназепам, клобазам (фризиум) и нитразепам (радедорм). При атипичных абсансах может быть эффективен суксилеп (но не как монотерапия). Показана высокая эффективность комбинации вальпроатов с ламикталом (2-5 мг/кг/сут и выше). В США широко используется комбинация вальпроатов с фелбаматом (талокса).
Прогноз при СЛГ тяжелый. Стойкий контроль над приступами достигается лишь у 10-20% больных. Прогностически благоприятно преобладание миоклонических приступов и отсутствие грубых структурных изменений в мозге; негативные факторы – доминирование тонических приступов и грубый интеллектуальный дефицит.
Несколько слов об «эпи»-признаках и заключении ЭЭГ.
Стандартное заключение ЭЭГ многословно, в нем подробно описываются особенности режима функционирования головного мозга. Большая часть описываемых изменений всего лишь нейрофизиологические особенности Вашего организма в данный момент времени и не требуют какой-либо лечебной коррекции, иными словами и с «легкими» и с «умеренными диффузными изменениями» на ЭЭГ люди живут долго и счастливо. Как правило ЭЭГ заключение должна завершать фраза о наличии или отсутствии «очаговых (локальных)» и «пароксизмальных» изменений/нарушений. Строго говоря и то и другое нормой не являются, но и каким-либо «однозначным приговором» никогда не были, наличие в описании ЭЭГ очаговых или пароксизмальных изменений мотивация посетить врача-невролога, который уже на основании ЭЭГ, других исследований и собственного диагностического мышления подскажет какой лечебной тактики надо придерживаться в каждом конкретном случае.
Даже при наличии типичных – как на картинке в учебнике – ЭЭГ изменений патогномоничных для эпилептических нарушений врач функциональной диагностики не имеет право поставить диагноз эпилепсия. Мало того, нередко за эпилептические пароксизмальные изменения принимают то, что к эпи-активности не имеет никакого отношения – например высокочастотную активность в бета-диапазоне (15 и более Гц). Подобный вид активности описывается как явление ирритации (по-русски: раздражение) и свидетельствует о высоком уровне возбуждения в коре. Он может быть признаком, к примеру, депрессивного расстройства, но никак не свидетельствует в пользу эпилепсии.
Ниже приведены «яркие» примеры пароксизмальных изменений эпилептического характера.

Нестойкая паркосизмальная активность — по типу «острые волны-медленные волны», искаженная, спровоцирована фотостимуляцией.

А вот такую активность можно назвать стойкой пароксизмальной и добавить «эпиформного характера», волны настолько высокие что на иллюстрации масштаб уменьшен в два раза.

У того же пациента «цифровая достройка» пространственной локализации очага патологической активности с помощью программы BrainLoc 6.0 (программа пространственной локализации источников патологической активности в структурах головного мозга)
Важно отметить что по сравнению с теми методами диагностики которые оказывают побочное «вредное» воздействие на организм – такие как рентген, МРТ, КТ — снятие биопотенциалов с поверхности тела человека при проведении ЭЭГ, ЭКГ – оказывает на самого человека не больше воздействия чем работающий рядом компьютер
Результаты исследований
Здоровые испытуемые характеризовались преобладанием на ЭЭГ альфа-активности, более выраженной в правом полушарии, и средними значениями коэффициента МПА, что согласуется с данными литературы . Пациенты с СФ отличались от здоровых испытуемых достоверно более низкими значениями показателей плотности мощности альфа-ритма в центральном (16,53 ± 1,68 мкВ2/Гц и 21,21 ± 1,89 мкВ2/Гц соответственно, p < 0,03) и теменном (22,56 ± 2,91 мкВ2/Гц и 28,74 ± 3,03 мкВ2/Гц соответственно, p < 0,02) отведениях правого полушария. Кроме того, у пациентов по сравнению со здоровыми было обнаружено достоверное увеличение плотности мощности бета-ритма в правом затылочном отведении (10,35 ± 1,08 мкВ2/Гц и 6,93 ± 0,61 мкВ2/Гц соответственно, p < 0,05), а также возрастание плотности мощности тета-ритма во всех отведениях правого полушария, не достигающее, однако, степени достоверности.
Наиболее значительные изменения, зарегистрированные нами у больных СФ, касались коэффициентов МПА. У пациентов наблюдалось достоверное уменьшение (p < 0,04) коэффициентов МПА для альфа-ритма в передней височной и центральной областях, а также «инверсия» (p < 0,004–0,03) МПА в средней височной и теменной областях, с преобладанием альфа-активности в этих областях в левом полушарии. Кроме того, у пациентов, наряду с достоверным снижением (p < 0,02–0,03) коэффициентов МПА для бета-ритма в средних височных и центральных областях, регистрировалась «инверсия» (p < 0,009–0,02) коэффициентов МПА в лобных, передних височных, задних височных, затылочных областях, с доминированием бета-активности в этих отделах в правом полушарии. И наконец, у больных отмечалось достоверное изменение (p < 0,05) коэффициентов МПА для тета-ритма в лобных и передних височных областях, с преобладанием тета-активности в этих областях в правом полушарии (табл. 1).
2006/41/2.png)
Таким образом, у пациентов с СФ были зарегистрированы значительные изменения плотности мощности и МПА во всех частотных диапазонах ЭЭГ.
Общие принципы лечения эпилепсии
В настоящее время выработаны общепринятые международные стандарты по лечению эпилепсии, которые необходимо соблюдать для повышения эффективности лечения и улучшения качества жизни пациентов.
Лечение эпилепсии может быть начато только после установления точного диагноза. Термины “предэпилепсия” и “профилактическое лечение эпилепсии” являются абсурдными. Существуют две категории пароксизмальных неврологических расстройств: эпилептические и неэпилептические (обмороки, снохождения, ночные страхи и пр.), и назначение АЭП оправдано только в случае эпилепсии. По мнению большинства неврологов, лечение эпилепсии следует начинать после повторного приступа. Единичный пароксизм может быть “случайным”, обусловленным лихорадкой, перегревом, интоксикацией, метаболическими расстройствами и не относиться к эпилепсии. В этом случае немедленное назначение АЭП не может быть оправданным, так как данные препараты являются потенциально высокотоксичными и не применяются с целью “профилактики”. Таким образом, АЭП могут применяться только в случае повторных непровоцируемых эпилептических приступов (т.е. при эпилепсии по определению).
В случае установления точного диагноза эпилепсии необходимо решить вопрос, следует или нет назначать АЭП? Разумеется, в подавляющем большинстве случаев, АЭП назначаются немедленно после диагностирования эпилепсии. Однако при некоторых доброкачественных эпилептических синдромах детского возраста (прежде всего, при роландической эпилепсии) и рефлекторных формах эпилепсии (эпилепсия чтения, первичная фотосенситивная эпилепсия и др.), допускается ведение пациентов без применения АЭП. Подобные случаи должны быть строго аргументированы.
Диагноз эпилепсии установлен и решено назначить АЭП. С 1980-х годов в клинической эпилептологии прочно утвердился принцип монотерапии: купирование эпилептических приступов должно осуществляться преимущественно одним препаратом. С появлением хроматографических методов определения уровня АЭП в крови стало очевидным, что многие антиконвульсанты имеют взаимный антагонизм, и одновременное их применение может значительно ослабить противосудорожный эффект каждого. Кроме того, применение монотерапии позволяет избежать возникновения тяжелых побочных эффектов и тератогенного воздействия, частота которых значительно возрастает при назначении нескольких препаратов одновременно. Таким образом, в настоящее время полностью доказана несостоятельность старой концепции о назначении большого количества АЭП одновременно в малых дозах. Политерапия оправдана только в случае резистентных форм эпилепсии и не более 3-х АЭП одновременно.
Подбор АЭП не должен быть эмпирическим. АЭП назначаются строго в соответствии с формой эпилепсии и характером приступов. Успех лечения эпилепсии во многом определяется точностью синдромологической диагностики (табл. 3).
АЭП назначаются, начиная с малой дозы, с постепенным увеличением до достижения терапевтической эффективности или появления первых признаков побочных эффектов. При этом определяющим является клиническая эффективность и переносимость препарата, а не содержание его в крови (табл. 4).
В случае неэффективности одного препарата, он должен быть постепенно заменен другим АЭП, эффективным при данной форме эпилепсии. При неэффективности одного АЭП нельзя сразу прибавлять к нему второй препарат, то есть переходить на политерапию не используя всех резервов монотерапии.
Принципы отмены АЭП.
АЭП могут быть отменены спустя 2,5-4 года полного отсутствия приступов. Клинический критерий (отсутствие приступов) является основным критерием отмены терапии. При большинстве идиопатических форм эпилепсии отмена препаратов может осуществляться через 2,5 (роландическая эпилепсия) — 3 года ремиссии. При тяжелых резистентных формах (синдром Леннокса-Гасто, симптоматическая парциальная эпилепсия), а также при юношеской миоклонической эпилепсии, данный период увеличивается до 3-4 лет. При продолжительности полной терапевтической ремиссии в течение 4-х лет, лечение должно быть отменено во всех случаях. Наличие патологических изменений на ЭЭГ или пубертатный период пациентов не являются факторами, задерживающими отмену АЭП при отсутствии приступов более 4-х лет.
Не существует единого мнения по вопросу о тактике отмены АЭП. Лечение может быть отменено постепенно в течение 1-6 мес или одномоментно по усмотрению врача.
часть-1 часть-2
